Các dạng bài bác tập Đại cương cứng về kim loại chọn lọc bao gồm đáp án cụ thể
Các dạng bài xích tập Đại cưng cửng về sắt kẽm kim loại chọn lọc tất cả đáp án đưa ra tiết
Phần Đại cưng cửng về sắt kẽm kim loại Hóa học lớp 12 sẽ tổng phải chăng thuyết, những dạng bài tập chọn lọc có trong Đề thi THPT nước nhà và bên trên 250 bài xích tập trắc nghiệm tinh lọc có đáp án bỏ ra tiết. Vào Xem chi tiết để theo dõi các dạng bài xích Đại cương về sắt kẽm kim loại tương ứng.
Bạn đang xem: Bài tập về đại cương kim loại
Tổng hợp lý thuyết chương Đại cương về kim loại
Lý thuyết Tính hóa học của Kim loại Lý thuyết Tính chất của hòa hợp kim Lý thuyết Dãy năng lượng điện hóa của kim loại Lý thuyết Sự điện phân – Sự ăn uống mòn Lý thuyết về sắt kẽm kim loại và vừa lòng kim Lý thuyết về tính chất của kim loại Lý thuyết về Điều chế kim loạiPhương pháp giải các dạng bài tập chương Đại cưng cửng về kim loại
5 dạng bài xích tập về sắt kẽm kim loại trong đề thi Đại học có giải bỏ ra tiết Dạng 1: Tính chất phổ biến của kim loại Dạng 2: Chuỗi phản nghịch ứng chất hóa học của kim loại Dạng 3: Các dạng bài xích tập về hàng điện hóa kim loại và pin năng lượng điện hóa Dạng 4: Phương pháp giải những bài toán về kim loại Dạng 5: Kim loại tác dụng với dung dịch axit Dạng 6: Kim loại chức năng với dung dịch muối Bài tập điện phân cơ phiên bản có lời giảiBài tập điện phân nâng cấp có lời giảiBài tập kim loại tính năng với dung dịch muối cơ bạn dạng có lời giảiBài tập kim loại công dụng với dung dịch muối nâng cao có lời giảiBài tập kim loại chức năng với H2SO4 đặc, nóng bao gồm lời giảiBài tập kim loại chức năng với HNO3 gồm lời giảiTổng hợp bài bác tập định hướng về bào mòn điện hóa tất cả lời giảiBài toán khử oxit kim loại bằng H2, teo hoặc C tất cả lời giảiBài tập kim loại công dụng với HCl, H2SO4 loãng tất cả lời giảiCâu hỏi định hướng đại cương kim loại trong đề thi đại học có lời giảiBài tập trắc nghiệm
80 câu trắc nghiệm Đại cương về sắt kẽm kim loại có lời giải cụ thể (cơ phiên bản – phần 1) 80 câu trắc nghiệm Đại cương về kim loại có lời giải cụ thể (cơ bạn dạng – phần 2) 100 câu trắc nghiệm Đại cương cứng về sắt kẽm kim loại có lời giải cụ thể (nâng cao – phần 1) 100 câu trắc nghiệm Đại cương về sắt kẽm kim loại có lời giải chi tiết (nâng cao – phần 2) 100 câu trắc nghiệm Đại cưng cửng về sắt kẽm kim loại có lời giải cụ thể (nâng cao – phần 3)Bài tập kim loại tác dụng với hỗn hợp muối cơ bản
I. Kiến thức và kỹ năng chung
1)Kim loại công dụng với hỗn hợp muối
Để kim loại M đẩy được kim loại X thoát ra khỏi dung dịch muối của nó với phản nghịch ứng: xM (r) + nX+ (dd) → xMn+ (dd) + nX (r)M đứng trước X vào dãy gắng điện rất chuẩnCả M cùng X phần đông không tác dụng được với nước ở đk thườngMuối gia nhập phản ứng cùng muối sinh sản thành nên là muối bột tanKhối lượng hóa học rắn tăng: ∆m↑ = mX tạo thành – milimet tanKhối lượng hóa học rắn giảm: ∆m↓ = mm tan – mX tạo raKhối lượng hóa học rắn tăng = khối lượng dung dịch giảmNgoại lệ:Nếu M là kim loại kiềm, kiềm thổ (Ca, Sr, Ba) thì M đang khử H+ của H2O thành H2 và sinh sản thành dung dịch bazơ kiềm. Sau đó là làm phản ứng điều đình giữa muối và bazơ kiềmỞ trạng thái nóng chảy vẫn đang còn phản ứng: 3Na + AlCl3 (khan) → 3NaCl + Al+ với nhiều anion tất cả tính oxi hóa mạnh khỏe như NO3-; MnO4- , …thì sắt kẽm kim loại M vẫn khử những anion trong môi trường xung quanh axit (hoặc bazơ)
Hỗn hợp các kim một số loại phản ứng với hỗn hợp dung dịch muối hạt theo máy tự ưu tiên: kim loại khử mạnh khỏe nhất chức năng với cation oxi hóa mạnh mẽ nhất để tạo thành kim nhiều loại khử yếu hèn nhất với cation thoái hóa yếu nhấtThứ tự tăng nhiều giá trị cố khử chuẩn (Eo) của một vài cặp thoái hóa – khử:Mg2+/Mg bội phản ứng của sắt kẽm kim loại với hỗn hợp muối là phản ứng thoái hóa – khử đề xuất thường sử dụng cách thức bảo toàn mol electron nhằm giải các bài tập phức tạp, khó biện luận như các thành phần hỗn hợp nhiều kim loại chức năng với hỗn hợp chứa hỗn hợp nhiều muối. Những bài tập đơn giản dễ dàng hơn như 1 kim loại chức năng với hỗn hợp một muối, hai kim loại công dụng với dung dịch một muối,…có thể đo lường và thống kê theo trang bị tự các phương trình phản bội ứng xảy raSử dụng phương thức tăng giảm trọng lượng để tính trọng lượng thanh sắt kẽm kim loại sau phản nghịch ứng,…Từ số mol ban sơ của những chất gia nhập phản ứng → biện luận những trường hòa hợp xảy raNếu chưa chắc chắn số mol các chất bội phản ứng thì dựa vào thành phần dung dịch sau phản ứng và chất rắn chiếm được → biện luận những trường thích hợp xảy raKim nhiều loại khử anion của muối trong môi trường xung quanh axit (bazơ) thì nên cần viết phương
trình dạng ion thu gọn
Kim loại (Mg → Cu) đẩy được sắt 3+ về sắt 2+. Ví dụ:Fe + 2Fe 3+ → 3Fe 2+
Cu + 2Fe 3+ → Cu 2+ + 2Fe 2+
Fe + 2Ag+ → fe 2+ + 2Ag.
Nếu sắt hết, Ag+ còn dư thì:
Fe 2+ + Ag + → fe 3+ + Ag
II. VÍ DỤ MINH HỌA
Bài 1: Nhúng thanh kim loại kẽm vào trong 1 dung dịch chứa tất cả hổn hợp 3,2 gam CuSO4 và 6,4 gam CdSO4. Hỏi sau khoản thời gian Cu với Cd bị đẩy hoàn toàn khỏi hỗn hợp thì cân nặng thanh kẽm tăng hay sút bao nhiêu?
Hướng dẫn:
Ta có: nCuSO4 = 3,2/160 = 0,02 (mol); nCdSO4 = 6,24/208 = 0,03(mol)
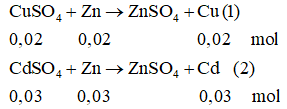
Từ (1) với (2) ⇒ ∑mCu + Cd = (0,02.64) + (0,03.112) = 4,64(gam)
và mZn gia nhập phản ứng = (0,02 + 0,03).65 = 3,25(gam)
Vậy trọng lượng thanh Zn tăng: 4,64 – 3,25 = 1,39(gam)
Bài 2: Ngâm một cái đinh fe vào 200 ml dung dịch CuSO4. Sau thời điểm phản ứng kết thúc, lấy đinh thoát ra khỏi dung dịch, cọ nhẹ, làm khô thấy trọng lượng đinh sắt tăng thêm 0,8 gam. Tính độ đậm đặc mol của hỗn hợp CuSO4 ban đầu.
Hướng dẫn:
Áp dụng phương pháp tăng bớt khối lượng
Theo phương trình: fe + CuSO4 → Cu + FeSO4
Cứ 1 mol sắt (56 gam) chức năng với 1 mol CuSO4 → 1 mol Cu (64 gam).
trọng lượng đinh fe tăng: 64 – 56 = 8 (gam)
Thực tế cân nặng đinh fe tăng 0,8 (gam)
Vậy, nCuSO4 phản ứng = 0,8/8 = 0,1(mol)và CMCuSO4 = 0,1/0,2 = 0,5M
Bài 3: cho 2,24 gam bột fe vào 200 ml dung dịch tất cả hổn hợp gồm có AgNO3 0,1M với Cu(NO3)2 0,5M, khuấy đông đảo tới bội nghịch ứng hoàn toàn, thu được chất rắn A cùng dung dịch B.
a) Tính số gam hóa học rắn A.
b) Tính nồng độ mol của những chất trong dung dịch B.
Hướng dẫn:
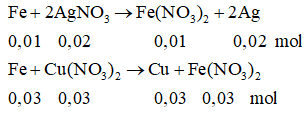
nAgNO3 = 0,02 (mol); nFe = 0,04 (mol); nCu(NO3)2 = 0,1(mol)
nFe phản bội ứng (1) = 0,01(mol); nFe pư (2) = 0,04 – 0,01 = 0,03 (mol)
nCu(NO3)2dư = 0,1 – 0,03 = 0,07 (mol)
chất rắn A gồm: 0,02 mol Ag cùng 0,03 mol Cu
⇒ mA = 0,02.108 + 0,03.64 = 4,08(gam)
dung dịch B: Fe(NO3)2: 0,04 (mol) ⇒ cm = 0,2 M
Cu(NO3)2: 0,07 (mol) ⇒ centimet = 0,35M
III. BÀI TẬP VẬN DỤNG
Bài 1: mang đến m gam hỗn hợp bột những kim loại Ni với Cu vào dung dịch AgNO3 dư. Khuấy kĩ cho đến khi làm phản ứng xong xuôi thu được 54 gam kim loại. Còn mặt khác cũng mang lại m gam tất cả hổn hợp bột những kim các loại trên vào hỗn hợp CuSO4 dư, khuấy kĩ cho tới khi làm phản ứng kết thúc, thu được sắt kẽm kim loại có cân nặng bằng
(m + 0,5) gam. Giá trị của m là:
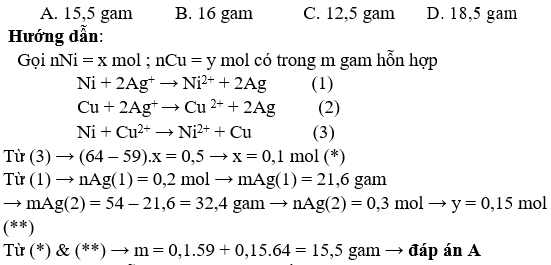
Bài 2: Hòa tan các thành phần hỗn hợp bột sắt kẽm kim loại gồm 8,4 gam Fe với 6,4 gam Cu vào 350 ml dung dịch AgNO3 2M. Sau khoản thời gian phản ứng xảy ra hoàn toàn thu được m gam hóa học rắn. Giá trị của m là:
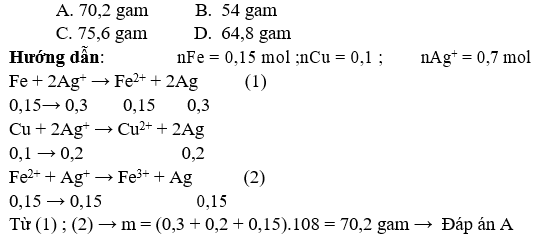
Bài 3: đến 2,24 gam bột fe vào 200 ml dung dịch đựng hỗn hợp có AgNO3 0,1M và Cu(NO3)2 0,5M. Sau khi các làm phản ứng xẩy ra hoàn toàn, thu được hỗn hợp X và m gam hóa học rắn Y. Quý hiếm của m là:
A. 2,80 gam B. 4,08 gam
C. 2,16 gam D. 0,64 gam
Hướng dẫn:
nFe = 0,04 mol ;nAg+ = 0,02 mol ; nCu2+ = 0,1 mol
Thứ tự những phản ứng xẩy ra là:
(Fe2+/Fe bài bác tập kim loại công dụng với H2SO4 đặc, nóng
A. Cách thức giải
Với việc này phải nhớ các bán làm phản ứng quan trọng sau: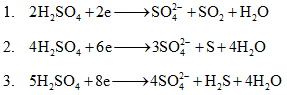
B. Lấy ví dụ minh họa
Câu 1: hòa hợp a mol sắt trong dung dịch H2SO4 thu được hỗn hợp X và 12,32 lít SO2 (đktc) là thành phầm khử duy nhất. Cô cạn dung dịch X thu được 75,2 gam muối bột khan. Quý giá của a là:
A. 0,4 B. 0,6
C. 0,3 D. 0,5
Định hướng bốn duy giải:
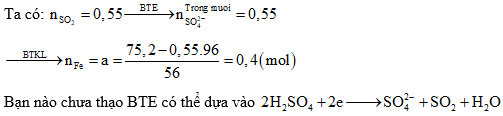
Giải thích tứ duy:
Bài toàn này đề không nói axit dư buộc phải không thể đến Fe nhảy hết lên
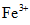
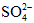
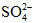
Câu 2: phối hợp hết hỗn hợp X cất Cu với Fe trong dung dịch H2SO4 đặc, nóng. Sau bội nghịch ứng thu được khí và dung dịch Y cất m gam muối (trong kia S chiếm 22,472% về khối lượng). Mặt khác, đổ dung dịch NaOH dư vào Y thấy tất cả 40,2 gam kết tủa xuất hiện. Giá trị của m là :
A. 74,2 B. 68,8
C. 71,2 D. 66,8
Định hướng tứ duy giải:
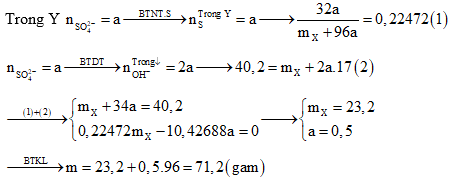
Giải thích tư duy:
Bài toán này đề ko nói axit dư yêu cầu không thể đến Fe nhảy hết lên
Câu 3: mang đến Fe chức năng hết với hỗn hợp H2SO4 sệt nóng chiếm được khí SO2 (sản phẩm khử duy nhất) và dung dịch X đựng 8,28 gam muối. đến Ba(OH)2 dư vào X thì nhận được 18,54 gam kết tủa. Số mol H2SO4 đã phản ứng là?
A. 0,15 B. 0,12
C. 0,20 D. 0,30
Định hướng tứ duy giải:
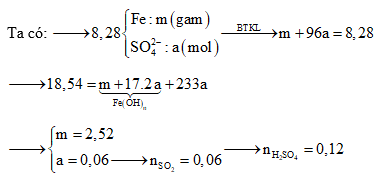
Giải thích tứ duy:
Bài toán này đề ko nói axit dư phải không thể mang đến Fe nhảy hết lên
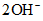
C. Bài bác tập vận dụng
Câu 1: Cho hỗn hợp A bao gồm x mol Fe cùng 0,2x mol Cu tan trọn vẹn trong dung dịch đựng y mol H2SO4 (tỉ lệ x : y = 1 : 3), chiếm được một thành phầm khử tốt nhất SO2 cùng dung dịch B. Số mol khí SO2 thoát ra là
A. x B. l,7x
C. 0,5y D. y
Định hướng tư duy giải
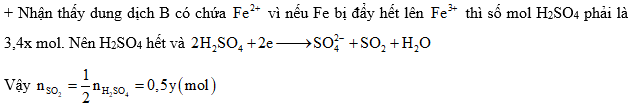
Câu 2: mang đến 12 gam tất cả hổn hợp hai sắt kẽm kim loại Cu, sắt tan trọn vẹn trong H2SO4 đặc, nóng, dư thu được 5,6 lít SO2 sản phẩm khử tuyệt nhất ở. Tính % theo khối lượng của Cu trong hỗn hợp là
A. 53,33% B. 33,33%
C. 43,33% D. 50,00%
Định hướng tứ duy giải

Câu 3: mang lại 4,5 gam một sắt kẽm kim loại R tan hoàn toàn trong H2SO4 đặc nóng dư chiếm được 2,24 lít tất cả hổn hợp hai khí SO2 cùng H2S (đktc) bao gồm tỉ khối so với H2 là 24,5 với dung dịch X. Tìm sắt kẽm kim loại R và trọng lượng muối tạo nên thành trong hỗn hợp sau bội phản ứng
A. Al, 28,5 gam B. Al, 34,2 gam
C. Xem thêm: Mẫu Người Yêu Lý Tưởng Trong Tim Con Gái Từ Bé Đến Lớn, Mẫu Người Yêu Lý Tưởng
Định hướng tư duy giải
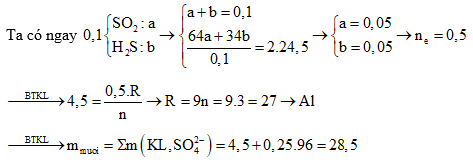
Câu 4: kết hợp 30 gam láo hợp một số kim loại vào hỗn hợp H2SO4 đặc nóng dư thu được dung dịch X với 0,15 mol SO2, 0,1 mol S và 0,005 mol H2S. Khối lượng muối tạo nên thành sau bội nghịch ứng là :
A. 78 g B. 120,24g
C. 44,4g D. 75,12g
Định hướng bốn duy giải
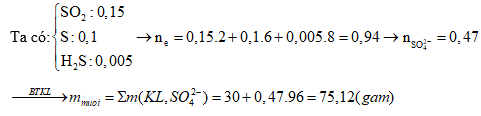
Câu 5: tổ hợp 23,4 gam láo hợp bao gồm Al, Fe, Cu bởi một số lượng vừa đủ dung dịch H2SO4, nhận được 15,12 lít khí SO2 (đktc) cùng dung dịch đựng m gam muối. Quý hiếm của m là:
A. 153,0 B. 95,8
C. 88,2 D. 75,8
Định hướng bốn duy giải
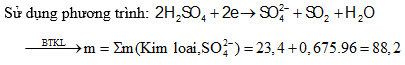
Câu 6: mang đến Fe chức năng hết vói dung dịch H2SO4 quánh nóng nhận được khí SO2 (sản phẩm khử duy nhất) và 8,28 gam muối. Biết số mol Fe bởi 37,5% số mol H2SO4 phản bội ứng. Khối lượng Fe vẫn tham gia bội phản ứng là
A. 1,68 gam B. 1,12 gam
C. 1,08 gam D. 2,52 gam
Định hướng tứ duy giải
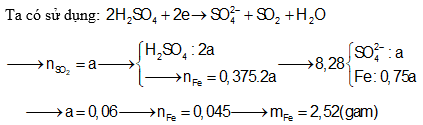
Câu 7: tổ hợp 0,1 mol Al và 0,2 mol Cu trong dung dịch H2SO4 đặc dư chiếm được V lít SO2 (ở 0°C, 1 atm). Cực hiếm của V là:
A. 3,36 B. 4,48
C. 7,84 D. 5,6
Định hướng bốn duy giải
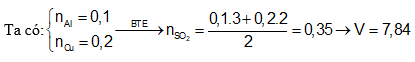
Câu 8: cho 5,94g Al công dụng vừa đầy đủ với dung dịch H2SO4 đặc rét thu được 1,848 lít sản phẩm (X) gồm lưu huỳnh (đktc), muối bột sunfat và nước. Cho biết (X) là khí gì trong nhì khí SO2, H2S?
A. H2S B. SO2
C. Cả hai khí D. S
Định hướng tứ duy giải
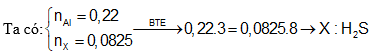
Câu 9: các thành phần hỗn hợp X tất cả Fe với C có tỉ lệ thành phần mol tương ứng là một trong những : 2. Mang lại 8 gam các thành phần hỗn hợp X chức năng với hỗn hợp H2SO4 đặc, nóng dư thì thu được V lít khí ở đktc. Quý giá của V là
A. 16,8 lít. B. 17,92 lít
C. 6,72 lít. D. 20,16 lít
Định hướng tứ duy giải
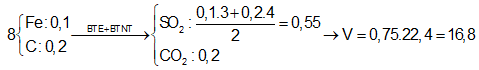
Câu 10: Hòa tan trọn vẹn 16,3 gam các thành phần hỗn hợp X gồm Mg, Al cùng Fe trong hỗn hợp H2SO4 đặc lạnh thu được 0,55 mol SO2. Mặt khác, đốt cháy hoàn toàn lượng sắt kẽm kim loại trên chiếm được m gam oxit. Quý hiếm của m là:
A. 22,9 gam B. 25,1 gam
C. 55,2 gam D. 51,8 gam
Định hướng tư duy giải
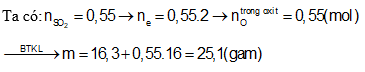
Giới thiệu kênh Youtube VietJack















