Phần kỹ năng về bảng tuần hoàn nguyên tố chất hóa học vô cùng quan trọng đối với các bạn học sinh trong quy trình học tập môn hóa học, nhất là đối với các bạn học sinh học tập khối từ nhiên. Bài viết tiếp sau đây nhằm giúp các chúng ta có thể dễ dàng phát âm được toàn bộ các phần thông tin kỹ năng của bảng này.
Bạn đang xem: Bảng hóa học tuần hoàn
Các phương pháp sắp xếp các nguyên tố trong bảng tuần trả hóa họcCấu tạo chi tiết và giải pháp đọc bảng tuần hoàn nguyên tố hóa học1. Ô nguyên tố2. Chu kỳ3. Nhóm (nguyên tố)Một số bí quyết ghi lưu giữ bảng tuần hoàn chất hóa học hiệu quả
Bảng tuần trả hóa học tốt còn được nghe biết là bảng tuần trả Mendeleev là viết tắt của bảng tuần hoàn các nguyên tố hóa học. Bảng này biểu hiện các yếu tố hóa học dựa trên cách sắp xếp số hiệu nguyên tử của những nguyên tố (số proton), thông số kỹ thuật electron và các quy lý lẽ tuần trả khác của chúng.

Bảng tuần hoàn chất hóa học được phát minh sáng tạo bởi Dimitri Mendeleev với được xây đắp ra sử dụng rộng rãi lần thứ nhất vào năm 1869. Từ đó trở về sau, bảng tuần hoàn này được công chúng mừng đón và đổi thay một tài liệu quan trọng cho các công trình khoa học. Dựa vào bảng tuần hoàn chất hóa học này, con tín đồ ngày nay có thể dễ dàng hiểu về sự vận hành của các nguyên tố và các quy hiện tượng khác vào khoa học.
Bảng tuần hoàn chất hóa học được áp dụng trong thời điểm hiện giờ đã được chỉnh sửa và không ngừng mở rộng thêm vị sự phân phát hiện các nguyên tố new khác. Mặc dù nhiên, về mặt hiệ tượng thì bảng tuần hoàn các nguyên tố hóa học hiện tại vẫn giữ được đúng phần lớn nét cơ bạn dạng của bảng tuần hoàn nơi bắt đầu của Mendeleev.
Các lý lẽ sắp xếp những nguyên tố trong bảng tuần trả hóa học
Trong bảng tuần hoàn những nguyên tố hóa học, các nguyên tố được thu xếp theo một biệt lập tự nhất thiết theo các nguyên tắc sau:
1. Sắp đến xếp các nguyên tố theo nhóm
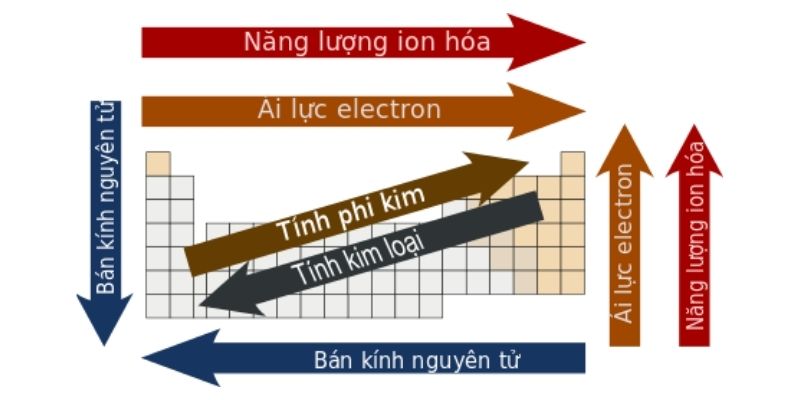
Nhóm (hoặc họ) là 1 trong cột trong bảng tuần hoàn các nguyên tố hóa học. Các nguyên tố xếp chung một tổ sẽ có cấu hình electron đồng nhất trong lớp hóa trị và vày đó các nguyên tố này sẽ sở hữu được tính hóa học hóa học tương tự nhau. Vào một nhóm, số hiệu nguyên tử và bán kính của những nguyên tố sẽ tăng vọt từ bên trên xuống dưới. Do đó, mức năng lượng của những nguyên tử sẽ tiến hành lấp đầy hơn, các electron bên cạnh cùng cũng trở thành cách xa hạt nhân hơn.
Đồng thời, xét từ bên trên xuống dưới, mức năng lượng ion hóa của các nguyên tử sẽ sút dần, hay các electron phía xung quanh sẽ dễ ợt bị bóc ra ngoài nguyên tử hơn. Tương tự, vào một nhóm, nguyên tử có số hiệu nguyên tử càng bự thì độ âm năng lượng điện càng sút (loại trừ mang đến trường hợp nhóm 11).
2. Sắp đến xếp các nguyên tố theo chu kỳ
Các nguyên tố được sắp theo chu kỳ nghĩa là được sắp xếp thành một hàng ngang vào bảng tuần hoàn. Theo hướng từ trái thanh lịch phải, nửa đường kính nguyên tử của nhân tố sẽ sút dần còn độ âm điện và tích điện ion hóa sẽ tăng vọt do sự tăng đột biến của số proton trong hạt nhân sẽ tạo cho e phần bên ngoài cùng được kéo lại ngay gần hơn

3. Sắp xếp theo phân nhóm
Có thể xếp những nguyên tố vào bảng tuần hoàn các nguyên tố chất hóa học vào 4 phân nhóm khác biệt là s, p, d với f. Theo IUPAC, electron sau cuối của nguyên tử nguyên tố được điền vào phân lớp làm sao (theo trình từ mức năng lượng) thì nguyên tố này sẽ thuộc phân team đó.
4. Một số cách thu xếp khác
Ngoài cha cách sắp xếp các nguyên tố như trên, người ta hoàn toàn có thể chia các nguyên tố trong bảng tuần hoàn chất hóa học thành 3 nhiều loại là á kim ,kim một số loại và phi kim.
Kim một số loại là những chất rắn, bao gồm ánh kim, có tác dụng dẫn nhiệt cùng dẫn năng lượng điện tốt. Những kim một số loại này hoàn toàn có thể kết phù hợp với nhau hoặc kết hợp với phi kim chế tạo ra thành hòa hợp chất. Với trong bảng tuần trả hóa học, kim loại thường tốt được phân chia ở phía bên trái và bên dưới.
Ngược lại, phi kim thường xuyên là các chất khí bao gồm màu hoặc không màu, không có khả năng dẫn nhiệt hay dẫn điện. Phi kim thường xuyên kết hợp với nhau để tạo nên thành hợp hóa học hóa trị, cùng thường được xếp ở phía bên yêu cầu và phía trên của bảng tuần hoàn.
Còn lại, làm việc giữa kim loại và phi kim chính là các á kim. Những nguyên tố này thường sẽ có được tính hóa học trung gian giữa kim loại và phi kim.
Cấu tạo cụ thể và phương pháp đọc bảng tuần hoàn nguyên tố hóa học
Tại thời điểm bây giờ, đối với phiên bạn dạng 113 yếu tố hóa học. IUPAC đã triển khai đưa thêm 3 thành phần khác phê chuẩn trở thành thành thành phần thiết yếu của bảng tuần hoàn. Những nguyên tố mới bao gồm số hiệu nguyên tử là 115, 117, 118. Như vậy, cùng rất nguyên tố 114 với 116, bảng tuần hóa những nguyên tố hóa học hiện nay tại có một chu kỳ 7 kha khá hoàn chỉnh. Khi nhìn vào một bảng tuần trả hóa học, sẽ có được các phần bao gồm được miêu tả như sau:
1. Ô nguyên tố
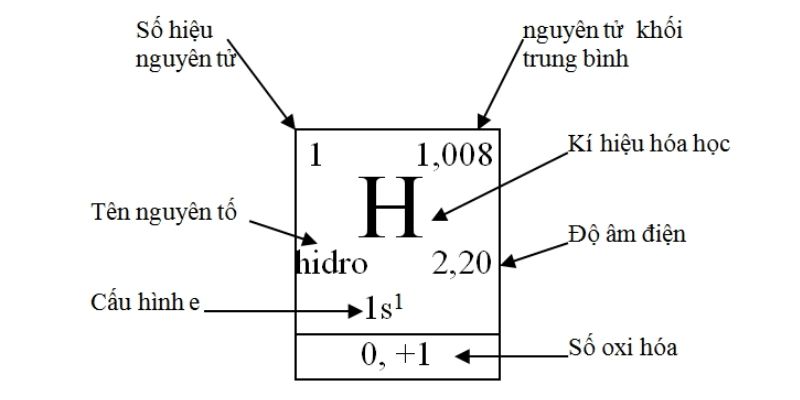
Các thành phần trong bảng tuần hoàn hóa học được biểu diễn hết sức cụ thể và chi tiết thành những ô như hình bên dưới.Mỗi ô gồm những thành phần tin tức như sau:
a. Tên yếu tắcTên nguyên tố có nghĩa là tên của nguyên tố hóa học được viết theo trường đoản cú vựng cổ điển của giờ Latin với Hy Lạp. Những nguyên tố này được phân biệt với nhau thông qua số hiệu nguyên tử hoặc số proton tất cả trong phân tử nhân của mỗi nguyên tử nhân tố đó.
b. Ký kết hiệu chất hóa họcKý hiệu hóa học chính là viết tắt tên của của một nguyên tố. Thường thì ký hiệu chất hóa học sẽ tất cả có từ 1 đến hai vần âm trong bảng vần âm Latin. Chữ cái trước tiên của ký hiệu hóa học đã là chữ cái viết hoa, còn chữ cái còn lại sẽ được viết thường.

Số hiệu nguyên tử cho thấy thêm số proton của một nguyên tố có trong trong phân tử nhân của một nguyên tử. Số này cũng đó là số năng lượng điện hạt nhân (điện tích dương) của nguyên tử yếu tắc đó. Bởi số hiệu nguyên tử của một nguyên tố là tốt nhất nên phụ thuộc vào số này, bạn có thể dễ dàng xác định được thương hiệu của nguyên tố đề xuất tìm. Ngoài ram lúc một nguyên tử không tích điện, thì số electron của lớp vỏ sẽ bởi với số hiệu nguyên tử.
Lưu ý: Số sản phẩm công nghệ tự ô yếu tố = số hiệu nguyên tử ( số e= số p= số năng lượng điện hạt nhân)
d. Nguyên tử khối trung bìnhNguyên tử khối trung bình là trọng lượng trung bình của hỗn hợp những đồng vị của nguyên tố kia theo một tỷ lệ xác suất các nguyên tử tốt nhất định.
e. Độ âm năng lượng điệnĐộ âm điện của một nguyên tử nguyên tố hóa học là khả năng hút electron của nguyên tử nguyên tố đó để tạo các liên kết hóa học. Vày đó, khi độ âm năng lượng điện của nguyên tử nguyên tố đó càng phệ thì tính phi kim đang càng bạo gan và ngược lại, giả dụ độ âm năng lượng điện của nguyên tử càng nhỏ tuổi thì tính phi kim sẽ nhỏ hay tính kim loại sẽ mạnh.
f. Cấu hình electron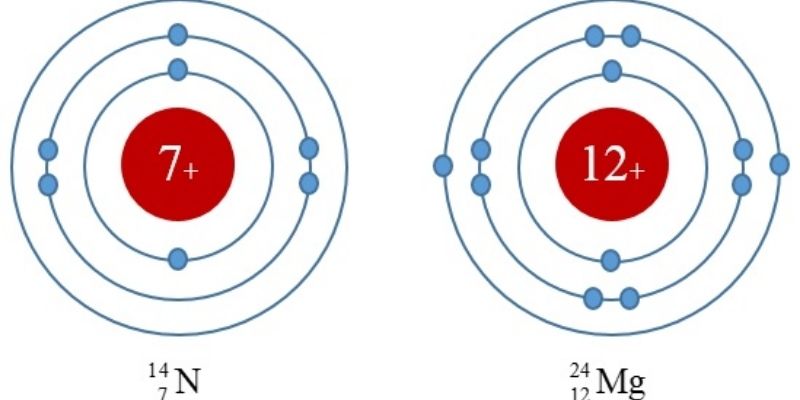
Cấu hình electron hay còn được gọi là thông số kỹ thuật điện tử, nguyên tử biểu thị sự phân bố những electron bao gồm trong lớp vỏ nguyên tử nguyên tố kia ở phần đông trạng thái tích điện khác nhau.
g. Số thoái hóaSố oxi hóa cho thấy số electron mà một hay nhiều nguyên tử nhân tố sẽ trao đổi với nguyên tử nguyên tố không giống khi tham gia vào một phản ứng thoái hóa khử.
Xem thêm: Báo Giá Màn Nhựa Pvc Ngăn Lạnh Tại Tphcm, Rèm Nhựa Pvc Ngăn Lạnh, Màn Nhựa Pvc Giá Rẻ Tphcm
2. Chu kỳ
a. Định nghĩaChu kỳ là một trong dãy những nguyên tố hóa học nhưng nguyên tử nhân tố đó gồm cùng số lớp e được sắp xếp theo chiều tăng cao điện tích hạt nhân.
b. Phân loại chu kỳ luân hồiHiện trên bảng tuần hoàn nguyên tố hóa học gồm có 7 chu kỳ:
Chu kỳ 1, 2 với 3 được gọi là chu kỳ nhỏ.
Chu kỳ 4,5,6 và 7 được call là chu kỳ luân hồi lớn. Vào đó, chu kỳ luân hồi 7 vẫn không được hoàn thiện.
Trong đó:
Chu kỳ 1: tất cả 2 nguyên tố là Hidro ( Z=1) với Heli (Z=2).
Chu kỳ 2: bao gồm 8 thành phần từ Liti (Z=3) mang lại Neon (Z=10).
Chu kỳ 3: gồm 8 thành phần từ Natri (Z=11) mang lại Argon (Z=18).
Chu kỳ 4: tất cả 18 nguyên tố từ Kali (Z=19) mang lại Krypton (Z=36).
Chu kỳ 5: tất cả 18 yếu tố từ Rubidi (Z=37) cho Xenon (Z=54).
Chu kỳ 6: có 32 thành phần từ Xesi (Z=55) đến Ranon (Z=86).
Chu kỳ 7: ban đầu từ yếu tố Franxi (Z=87) đến nguyên tố Z=110.
c. đặc điểm chu kỳ vào bảng tuần hoàn hóa học, các nguyên tố và một một chu kỳ sẽ có được số lớp electron cân nhau và ngay số thứ từ bỏ chu kỳ. Một chu kỳ sẽ ban đầu từ một kim loại kiềm và xong xuôi bằng một nhân tố khí hiếm. Nhì hàng cuối của bảng tuần hoàn chất hóa học là nhị họ nhân tố có thông số kỹ thuật e nhất là : chúng ta Latan gồm 14 nguyên tố thuộc chu kỳ 6 với họ Actini gồm 14 thành phần thuộc chu kỳ 7.3. Nhóm (nguyên tố)
a. Định nghĩaNhóm nguyên tố tốt còn được viết tắt là nhóm, là tập hợp toàn bộ các nguyên tố cơ mà nguyên tử của nó có thông số kỹ thuật electron tựa như như nhau, vì chưng vậy tính chất hóa học của bọn chúng cũng gần như giống nhau. Những nguyên tố như vậy sẽ tiến hành xếp thành một cột, với được gọi chung là 1 nhóm.
b. Phân một số loại nhóm nguyên tốBảng tuần hoàn hóa học được chia thành 8 đội A và 8 team B (riêng team VIIIB gồm 3 cột).
Nhóm A: tất cả nguyên tố team s cùng nguyên tố team p. Những nguyên tố của nhóm này gồm số tự nhóm bằng với số lớp e xung quanh cùng.
Nhóm B: gồm những nguyên tố team d với nhóm f. Những nguyên tử nguyên tố của những nhóm này thông thường sẽ có thông số kỹ thuật e ngoài cùng nghỉ ngơi dạng (n-1)dxnsy . Khi đó, cách xác định nhóm của các nguyên tố này đã được triển khai như sau:
+ Trường hợp 1: Tổng (x+y) có mức giá trị từ 3 cho 7 thì nguyên tử yếu tố này đang thuộc nhóm (x+y)B. + Trường thích hợp 2: Tổng (x+y) có mức giá trị tự 8 đến 10 thì nguyên tử nguyên tố vẫn thuộc team VIIIB. + Trường hòa hợp 3: Tổng (x+y) có giá trị to hơn 10 thì nguyên tử nguyên tố đó sẽ thuộc nhóm (x+y-10)B.Các nhân tố s, p, d, f vào bảng tuần trả nguyên tố hóa học:
Nguyên tố s: bao hàm những nguyên tố đội IA cùng IIA. Các nguyên tử nguyên tố s sẽ có electron sau cùng được điền vào phân đội s.
Nguyên tố p: bao hàm những nguyên tố đội IIIA mang lại nhóm VIIIA ( loại trừ Heli). Electron sau cuối của nguyên tử nguyên tố phường sẽ được phân chia vào phân nhóm p.
Nguyên tố d: là các nguyên tố thuộc nhóm B tất cả electron sau cuối được điền vào phân nhóm d.
Nguyên tố f: là những nguyên tố thuộc họ Lantan với Actini. Giống như như các nguyên tố trên, nhân tố f gồm electron sau cùng được điền vào phân đội f.
c. Nhấn xét:Nguyên tử của những nguyên tố cùng nhóm sẽ sở hữu được cùng số electron hóa trị và số máy tự team (trừ 2 team VIIIB sau cuối của bảng tuần hoàn)















